本周看点
1.恒瑞/璎黎药业重磅1类新药获批上市
2.国产第三款门冬胰岛素30注射液获批上市
3.卓和药业/亚宝药业1.1类中药报上市
4.箕星药业引进的1 类心衰新药申报上市
本期(11月4日至11月11日),首款国产高选择性PI3Kδ抑制剂获批上市,国产门冬胰岛素30注射液迎来第三家,K药适应症再次拓展,箕星药业4亿美元引进的心衰新药国内申报上市,更多动态如下:
国内审评审批·新动态
本期CDE有37个受理号(32个品种)报生产办理状态更新,其中璎黎药业的林普利塞片、东阳光药的门冬胰岛素30注射液、以及默沙东的帕博利珠单抗注射液备受关注。更多动态如下:
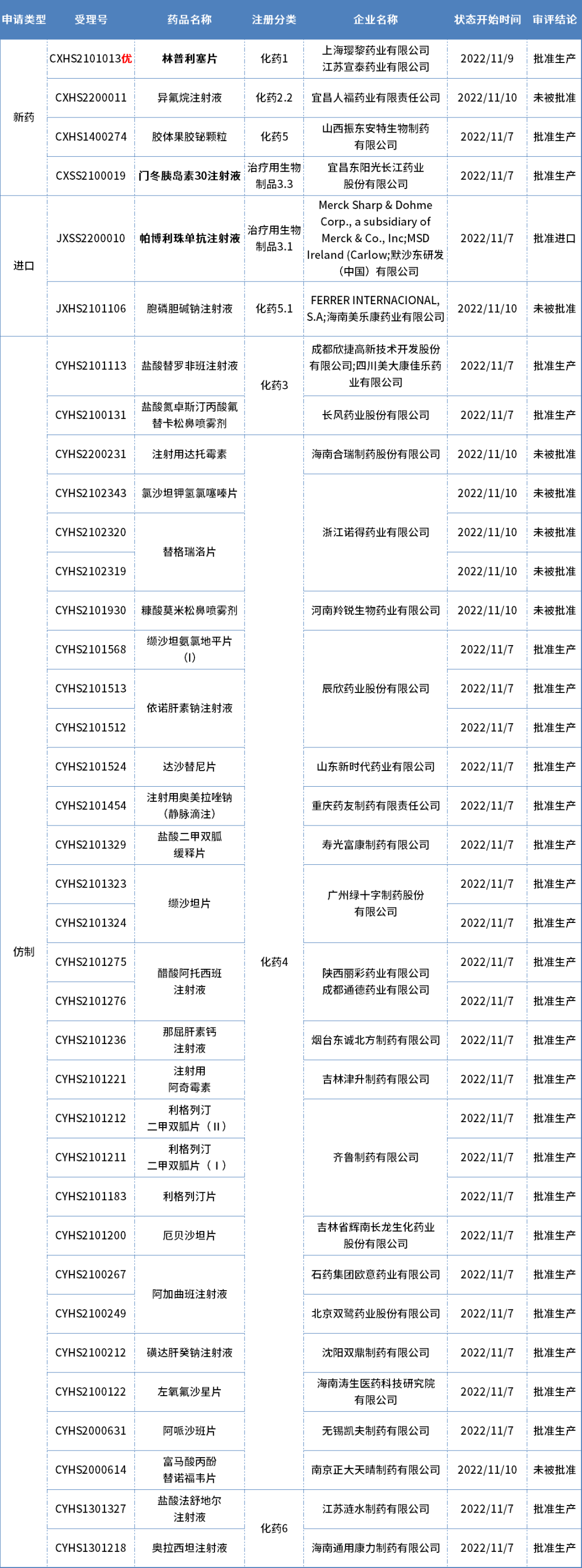
数据来源:药智数据
恒瑞/璎黎药业重磅1类新药获批上市
日前,国家药监局通过优先审评审批程序附条件批准上海璎黎药业的1类创新药林普利塞片(linperlisib,商品名:因他瑞)上市,适用于既往接受过至少两种系统性治疗的复发或难治滤泡性淋巴瘤成人患者。这是我国首个获批上市的高选择性PI3Kδ抑制剂,也是恒瑞医药BD领域首个获批上市的创新药。
林普利塞由上海璎黎药业研发,恒瑞医药于2021年2月对璎黎药业进行2000万美元股权投资(占总股本6.67%),并获得了林普利塞在大中华地区的联合开发权益以及排他性独家商业化权益。
此前,林普利塞曾获得NMPA颁发的用于治疗R/R FL的突破性疗法认定,以及美国FDA颁发的FL、慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)和T细胞淋巴瘤适应症的三项孤儿药资格认定。在2022年公布的林普利塞治疗R/R FL患者的中国II期临床试验最新数据显示,林普利塞治疗R/R FL患者的有效率接近百分之八十,并表现出可控的安全性。
不过,近几年来,靶向PI3K的药物暴露出越来越多的安全性问题,多个药物因安全性问题引发退市或者放弃上市申请,仅仅在2022年,就有包括Incyte公司、MEI Pharma公司、TG Therapeutics等三家公司的PI3K药物被FDA拒绝上市或者主动放弃上市申请。此次在中国获批的林普利塞,大概率是近期全球范围内唯一上市的PI3K抑制剂药物。
东阳光药门冬胰岛素30注射液获批上市
日前,东阳光药的门冬胰岛素30注射液获NMPA批准上市。药智数据显示,这是第三款获批的国产门冬胰岛素30注射液,另两款分别来自甘李药业和珠海联邦制药,此外,通化东宝、吉林惠升生物也已提交上市申请。
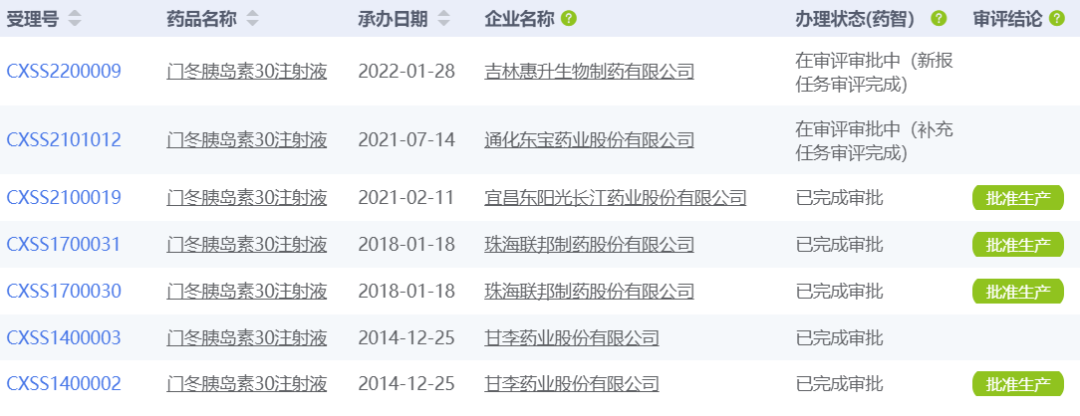
数据来源:药智数据
门冬胰岛素是诺和诺德研发的短效胰岛素类似物,门冬胰岛素30注射液是第三代预混胰岛素类似物,含30%可溶性门冬胰岛素和70%精蛋白门冬胰岛素,适用于糖尿病的治疗,可临餐注射,其糖化血红蛋白(HbA1c)达标率更高,能同时更好的控制空腹和餐后血糖,在改善血糖控制、减少低血糖风险、提高依从性以及节约医疗成本方面优势明显,更适合低血糖感知受损的高危患者。
默沙东PD-1在华获批第10项适应症
近日,默沙东PD-1抑制剂帕博利珠单抗(商品名:可瑞达??)一项新适应症获NMPA批准,联合化疗新辅助治疗并在手术后继续帕博利珠单抗单药辅助治疗,用于经充分验证的检测评估肿瘤表达PD-L1(综合阳性评分(CPS)≥20)的早期高危三阴性乳腺癌(TNBC)患者的治疗。
这是帕博利珠单抗在中国获批的第10个适应证:
①二线治疗晚期黑色素瘤
②一线治疗PD-L1表达≥1%、无EGFR/ALK突变的晚期NSCLC
③联合化疗一线治疗无EGFR/ALK突变的晚期非鳞NSCLC
④联合化疗一线治疗晚期鳞状NSCLC
⑤二线治疗食管癌
⑥一线治疗CPS≥20的晚期头颈鳞癌
⑦一线治疗MSI-H/dMMR结直肠癌
⑧一线治疗食管癌
⑨二线治疗肝细胞癌
⑩一线治疗CPS≥20的早期高危三阴性乳腺癌(TNBC)
国内审评审批·新受理
本期CDE新增报生产受理号88个,共60个品种,其中卓和药业的风叶咳喘平口服液和箕星药业引进的Omecamtiv Mecarbil缓释片备受关注,更多动态见下表:
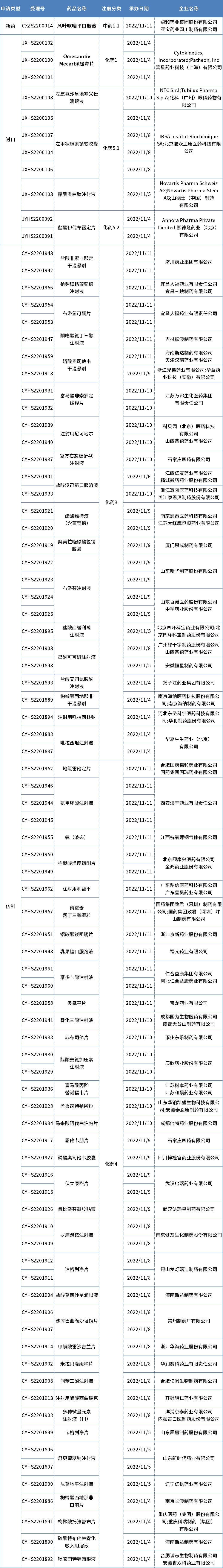
数据来源:药智数据
卓和药业/亚宝药业1.1类中药报上市
风叶咳喘平口服液是由卓和药业集团股份有限公司与亚宝药业四川制药有限公司开发一款1.1类中药,用于治疗急性支气管炎咳嗽。
近年来,国家持续发布中医药战略发展利好政策,自2020版中药注册分类(2020年7月1日起实施)实施以来,已有多款1类中药创新药申报上市,其中9款已获批上市,8款还在审评审批中。
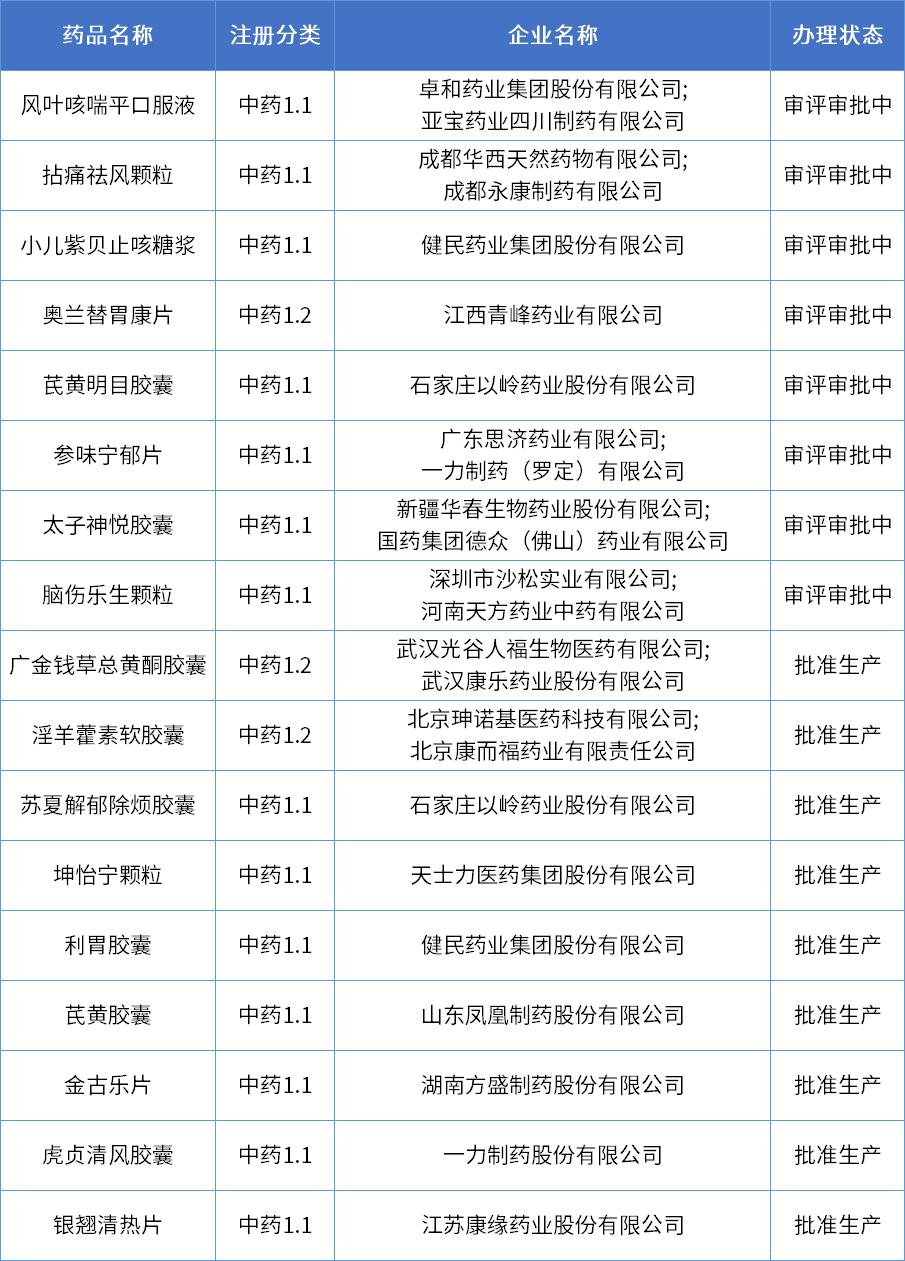
数据来源:药智数据
箕星药业引进的1 类心衰新药申报上市
药智数据显示,箕星药业/Cytokinetics提交的omec amtiv mecarbil缓释片申报上市已获受理,用于治疗射血分数降低的心力衰竭(HFrEF)。该药由箕星药业从Cytokinetics公司引进,箕星药业拥有omecamtiv mecarbil治疗射血分数降低的心力衰竭(HFrEF)这一拟定适应症在大中华区的开发和商业化权力,Cytokinetics公司获得7000万美元的承诺资金,以及有资格从箕星药业获得最高3.3亿美元的额外里程碑付款。
据箕星药业新闻稿,omecamtiv mecarbil是一种首创选择性小分子心肌肌球蛋白激活剂在研新药,旨在增加每个心动周期中的活性肌动蛋白-肌球蛋白横桥数量,从而在射血分数降低的心力衰竭(HFrEF)患者中增强受损的心肌收缩力。
今年2月,美国FDA受理了omecamtiv mecarbil的新药上市申请,PDUFA日期为2022年11月30日。本次该药上市申请获CDE受理,意味着该药也将给国内心衰患者带来更多治疗选择。
数据来源:药智数据、企业公告等网络公开数据
信息来源:药智网、企业公告等网络公开信息




 Pre
Pre
 ;*All our products are for R&D,not for human.
;*All our products are for R&D,not for human.